【简介】
水性锌离子电池(AZIB)研究的蓬勃发展是基于对电池安全性和成本友好性的期望。作为少数能在水溶液中可逆地剥离/沉积的富土金属之一,锌还具有其他优势,如高比容量、低价格、理想的氧化还原电位、环境友好等,这使其成为水电解质中的理想阳极。尽管近三年来关于这一主题的出版物数量激增,但对电池运行过程中的局部化学(电极/电解质界面、电荷载体的溶解/去溶剂化、SEI/CEI的形成等)的理解仍然难以实现。一个完整的电池需要3个主要组成部分,即阳极、阴极和电解质,其中电解质通常被认为只是离子的输送者,其研究的关注度相对较低。对于AZIBs,"1 M "浓度的ZnSO4 或ZnOTF是从传统的非水系锂离子电池中继承下来的,其中离子电导率和Li+ 迁移数都得到了优化。后来 "盐中水 "的概念被提出,AZIB界在电解质设计方面遵循 "越多越好 "的原则。与Li+ 不同的是,Li 的小半径往往与阴离子的对应物产生大小不匹配,导致盐的高溶解度,而含锌盐本身更难实现 "盐中水"。在电解质浓度方面,一些研究人员正在挑战浓度极限,而另一些研究人员则着眼于某些低浓度,以达到特定目的,并在实际应用时尊重成本问题。
水系电解质有许多吸引人的优点,如不易燃性和环境友好性,但也被诅咒为低能量密度。为了解除这个诅咒,人们做出了许多努力来重新配制水系电解质,如果不了解电解质的物理特性和电化学性能之间的相互作用,这似乎不太可能成功。
本文讨论了锌离子电池电解质的各种配方如何导致不同的电化学性能。通过评估电池的电化学性能的五个指标,提供了一种具有不同电池用途的单点电解液设计策略。该综述侧重于说明为什么不同的电解质配方会有如此不同的全电池电化学性能,以及电解质中不同类型/数量的离子如何影响阳极和阴极的化学。此外,为了更深入地了解锌水电解质的设计,本文还讨论了电解质成分和浓度、其物理化学性质、电化学性能和成本之间的相关性。
一、电导率和迁移数
重要的特性是,电解质应充分快速地输送电荷载体。溶剂在导电性方面起着重要作用,这不仅是因为盐在特定溶剂中的浓度限制,而且电荷载流子在溶液中移动时被溶解,即被溶剂分子护送。为了量化离子在溶液中的运输能力,离子电导率(σ)被表示为所有带电成分运输的总和(1)σ=∑zi F ci µi,其中离子成分的电荷(zi)、浓度(ci)和移动性(μi)影响对离子电流的贡献。然而,对于摇椅型电池来说,溶液的高离子导电性并不能直接转化为良好的电解质,因为离子导电性是所有离子种类(包括正电和负电)集体运动的结果,而法拉第电流只由一种类型的离子(主要是正电)平衡。
在非水系LIB电解质(碳酸酯或醚基)中,溶剂的极化程度较低,较难移动,1M浓度就能达到最大电导率(∼10 mS/cm),这在不增加电解质粘度的情况下提供足够的阳离子传输。由于无机溶剂的简单性,Li+将成为主要的正离子成分,迁移数为∼0.4,比未溶剂化的阴离子稍微迟钝一些。
众所周知,由于水作为溶剂的介电常数高,水系ZIB电池的电导率要高10倍。典型的1 M ZnSO4显示的离子电导率为50 mS/cm,然而,由于H+(或H3O+)的存在,如此高的电导率可能是一个过于乐观的指标,由于离子传导的跳跃机制,它通常被称为具有高迁移率。增加Zn2+的浓度不仅会增加电解液的导电性,而且会使溶液酸化,从而诱导更多的质子从水中出来,质子的跳跃机制对离子的导电性有很大的帮助,但对电池的运行是不利的。
显然,水溶液的高导电性可能是以Zn2+的低迁移数H+的高迁移数为代价的。在测量中是否有办法区分它们?不幸的是,经典的Bruce-Vincent方法是基于Zn的氧化还原活性成分的假设,这是不正确的,因为H+ /H(SHE,0 V)的氧化还原电位位于Zn2+ /Zn(-0.78 V vs. SHE)之上。更具体地说,它使用稳态电流除以脉冲电流来评估迁移数:图片,但稳态电流是由Zn2+沉积和H+还原贡献的,计算值将是H+和Zn2+的迁移数的总和(图1a)。更糟的是,正如Xu等人所指出的,电解质浓度远远超出了Bruce-Vincent方法保持其准确性的范围(低于0.01M)。除了电化学测量,PF-NMR还有其长期存在的问题,即计算零净电荷离子对和负电荷离子对的金属离子迁移率。对水溶液中离子的迁移数的研究暗示了这种离子对的意义,一旦浓度超过∼0.14M,Zn2+的迁移数就会突然下降(在ZnCl2和 ZnSO4中都是如此)。但在电解质中,这些离子对对离子电流没有贡献(负电荷离子对甚至抵消了离子电流),如图1b所示。飞秒刺激拉曼光谱(FSRS)揭示了ZnCl2水溶液(5 ∼ 30 molality (m))中的离子规格,这是离子对的一个有力证据(图2a),其中[Zn(OH2)2Cl4]在所有浓度中占主导地位,Zn[(OH2) 6] 2+显示出更弱的强度。而且这种正负离子规格化在几种不同的溶液中都能观察到。
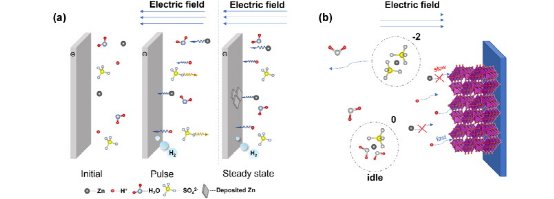
图1. (a) Bruce-Vincent方法的离子电导率测量示意图,其中H+和Zn2+都被还原,对脉冲和稳态电流有贡献。(b) α-MnO2阴极上的放电过程示意图,其中离子对抵消(或不贡献于)离子电流,缓慢的Zn2+插层过程被快速的H+插层所抑制。

图2. (a) 不同浓度的ZnCl2 溶液的拉曼光谱。(b) 沿着[010](左)和[001](右)的投影对放电的α-MnO2 进行扫描透射电子显微镜(STEM)分析。(c) α-MnO2 ,在第一周期和第二次放电期间的原位XRD。
不幸的是,水系锌电池在本质上总是会被离子对和质子纠缠,因为不仅Zn2+电导率的精确测量被H+ ,甚至ZIB阴极的电化学性能也可能是H+(去)插层的结果(图1 b)。MnO2作为一个典范的阴极,其工作机制因H+和Zn2+的共存而变得复杂。在各种相中,α-MnO2 首先被报道为质子是MnO2 ⇔ MnOOH转化反应的主要电荷载体,但后来这种机制被Zn2+插入和Zn2+/H+共插入的报道所推翻,使其工作机制更加令人费解。在H+转换、H+(去)插入和Zn2+/H+共同(去)插入之间还不能达成共识。Lu等人最近提出使用高角度环形暗场(HAADF)来分析放电的α-MnO2, ,其没有重离子的空通道支持H+ (de)insertion(图2b)。根据原位XRD,α-MnO2模式在所有电荷状态下都持续存在(图2C),这排除了转换型机制。α-MnO2,在硫酸锌电解液中的复杂工作机制归结为H+(去)插入,同时保持隧道结构。
电化学稳定性窗口(ESW)
水的狭窄稳定性窗口一直是水电池的致命弱点,这对AZIB的能量密度也造成了限制。为了扩大ESW,已经做了许多努力,如集流体的设计、助溶剂和电解质的净化等。在本节中,我们倾向于关注高浓度盐水电解质(WISEs)及其对大量电解质的电化学特性的影响。为了简单起见,通常在高浓度下发生的SEI效应将保留在下一节,同时讨论浓度对SEI形成的影响。
由于Wang等人的努力,WISE现在已经成为电池界一个众所周知的概念,并显示出巨大的ESW扩展效应。如前所述,电解质中的电荷载流子被水溶解,无论是在阳极上的沉积还是在阴极上的插层,都会在界面上得到去溶剂化。这种去溶剂化导致无主水在电场最强的界面上积累,随后,水在电化学上被分解成H2(HER)或O2(OER)。通过引入高浓度,Zn2+的溶解鞘中的自由水耗尽,而阴离子倾向于填补(图3a)。随后,溶解的H2O被溶解的阴离子取代,导致H2O在界面上的积累被更加电化学稳定的阴离子积累所取代,瞧,水分裂被抑制,ESW被扩大。谨慎的读者可能会发现这里有一个悖论,即Zn2+-阴离子对在上一节中伤害了电解质的导电性,但在这里却有利于ESW的扩大。事实证明,对于众多的WISE来说,较高的浓度确实常常导致ESW的扩展和电导率的降低(图3b)。
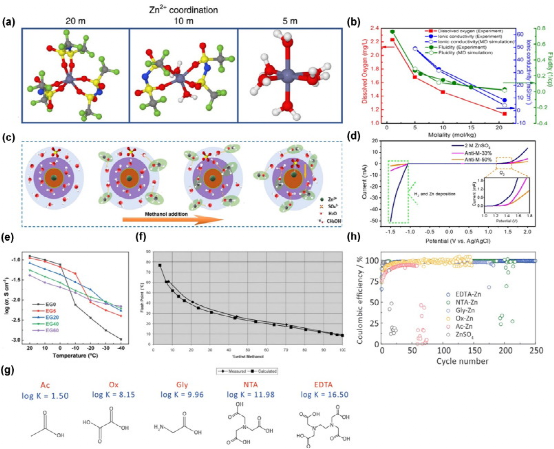
图3. (a) 1M Zn(TFSI)2 和三种浓度的LiTFSI(5M、10M和20M)的电解质中的Zn2+ -溶剂化结构。 (b) 25 °C时在不同浓度电解质(LiTFSI-H2O)中的Li+电导率和流动性。 (c) Zn2+ 溶剂化鞘随甲醇加入而变化的示意图。(d) 不同电解质的LSV扫描,其中33%和50%代表体积百分比甲醇。 (e) 不同比例的EG/H2O的电解质的离子传导率。 (f) 甲醇/H2O混合物闪点随浓度的变化。 (g) 具有不同K值的配体的分子模型。(h) 具有不同配体的Cu//Zn半电池的CE稳定性。
按照同样的逻辑,研究人员可以实现类似的溶剂化鞘置换,而不会使浓度过高而不切实际。具有较高古特曼供体数的溶剂往往优先溶解阳离子,在稀释的ZnSO4水溶液(H2O的供体数:18)中加入DMSO(供体数29.8),用DMSO取代部分溶解水,形成[Zn(H2O)4 (OH)3 (DMSO)]−等络合物。因此,电解质的阴极稳定性得到改善,同时库仑效率(CE)也更高。据报道,各种有机溶剂作为 "助溶剂 "或 "反溶剂 "是有效的电解质添加剂,以扩大水电解质的ESW。Qiao等人报道了50v%的甲醇添加量用于Zn2+溶剂化结构的重建和ESW的扩展(图3c和3d),其中观察到电解质更宽的温度稳定性是继承自甲醇的物理化学稳定性。其他具有电子密集位点(通常是N-或O-基)来配位Zn2+的有机溶剂已被广泛报道为辅助溶剂,如乙腈、乙二醇和1,4-二氧六环等。然而,应该指出的是,有机溶剂的添加有其自身的局限性。正如Li等人报告的那样,随着EG/H2O电解质混合物中EG含量的增加,在室温下离子导电性明显下降,这往往导致较差的速率性能和高电压滞后(有时被误解为更宽的ESW)。此外,加入有机溶剂带来的一个更致命的问题是电解液的可燃性更高,如图3f所示,当增加甲醇/水混合物中的甲醇浓度时,闪点低于室温。这种不利影响将抹杀水系电解质的独特性,并模糊了水系和非水系之间的界限。除共溶剂策略外,螯合剂可以与Zn2+,而不改变水系的物理化学性质,具有很强的配位作用。Yang等人比较了各种螯合配体的稳定常数(K),作为Zn2+和配体之间结合强度的指示,显示具有高K值的乙二胺四乙酸通过较少的HER和长循环稳定性的形式显示出更好的阴极稳定性(图3g和3h)。然而,这类螯合剂添加剂应谨慎处理浓度,因为与Zn2+的螯合强度通常太强,Zn2+在溶液中保持电离。例如,EDTA添加剂通常使用0.05M,如果浓度达到更高,人们可能会观察到Zn2 EDTA沉淀,而不是均匀的溶液。
尽管电化学性能有所提高,但与WISEs策略相比,低浓度溶质鞘替代往往显示出较差的效果,其中一个主要原因是由于没有自由水,WISEs中的SEI更为坚固和紧凑。除此之外,我们认为动力学因素在区分HER和OER等异质反应方面也起着重要作用,这些反应的动力学由于液气相变而变得迟缓。WISE较高的粘度会延缓电极反应和水分离,而前者的反应通常是沉积(液-固)或(脱)插层(液-固),这比后者(液-气)的动力学表现更好。这两个反应之间的动力学差异被更粘稠的电解质所放大,两个反应都被延缓,但程度不同。相对而言,更迟钝的HER/OER反应似乎被抑制了,而电极反应似乎保持不变。同样的道理可以用来解释为什么在低温研究中,水电池经常显示出更宽的ESW(在较低的温度下更粘稠),而且像淀粉这样的聚合物也可以成为水电池的良好电解质添加剂(增加电解质的粘度)。
二、固体电解质界面(SEI)
曾经有一段时间,固体电解质界面(SEI)被认为是非水电解质的特权,因为水的分解产物(H2和OH-)并不构成阳极上的固体保护层。然而,在水电解质中仍然可以观察到SEI,而且大多数与高浓度的WISE有关,原因有二。首先,WISE中阳离子和阴离子的接触离子对提高了阴离子的还原电位,这使得阴离子的分解优先于HER,为SEI提供了原料。其次,一个稳定的SEI需要将溶解度降到最低,这是通过使溶剂中的水被溶解盐占据而不是溶解SEI实现的。Wang等人的研究表明,即使是在20M LiTFSI中稳定的、结构良好的SEI,它在1米LiTFSI的稀溶液中也会迅速溶解,导致由于HER引起的高不可逆性(图4a)。
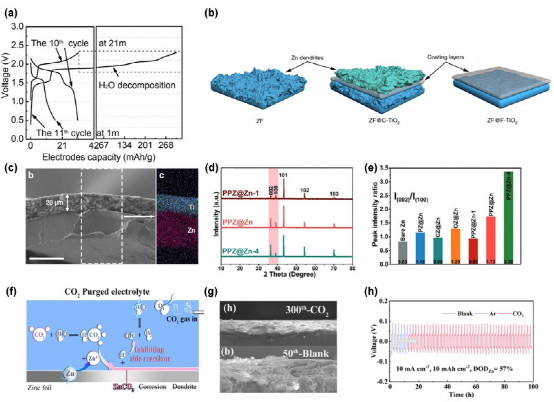
图4. (a) 在WiSE(21m)中预形成SEI 10个循环(基于两个电极的质量)之后,在1mLiTFSI/H2O中的水性Li离子LiMn2O4/Mo6S8全电池。。 (b) 不同TiO2 面的镀层的Zn电镀过程示意图。 (c) 10个循环后的(0 0 1)面镀层的SEM和相应的EDX图谱图像。 (d) 用磷酸处理1、2和4分钟的锌箔的XRD图。 (e) 裸锌和锌化合物@锌样品的I(0 0 2)/I(1 0 0)比率。 (f) 2 M ZnSO4 电解液中锌阳极上的界面反应示意图,以及在CO2 -净化电解液中对这些副反应的禁止。(g) 在CO2 吹扫的电解液(上)和空白电解液(下)中循环的Zn阳极的SEM截面图。(h)在高放电深度下的对称电池与薄Zn箔测试。
到目前为止,由于Li+的小半径与笨重的阴离子的尺寸不匹配效应,大多数WISE是含Li+的盐。Zn2+版的电解质盐,连同其'阳离子-阴离子对,更难实现盐中水溶液。Cl-阴离子不能进一步还原,形成不溶性的SEI/ClO4-是一个很好的候选者,其高价态的Cl7+可以被分解并形成含Cl的SEI,但溶解度的限制排除了这种配方的WISE可能性,在以下循环中不能保持生成的SEI的完整性 。一个更好的方法是使用高溶解度的盐LiTFSI作为基体,通过添加ZnTFSI来提供电荷载体,类似的WISEs改进是通过1m ZnTFSI + 20m LiTFSI实现的,但对该电解液的SEI组成的描述有限。除LiTFSI基质外,其他配方如20 m NaFSI+0.5 m Zn(TFSI)2 、1 m Zn(CF3SO3) 2 + 21 m LiTFSI、0.5 m Zn(ClO)42 + 18 m NaClO4 也显示了电化学的改善。选择基质的共同点是存在一个笨重的阴离子与一个小的单价阳离子耦合。这样的设计不仅保证了高浓度,而且有利于Zn2+ -阴离子对(单价阳离子不太可能形成)。
除了浓度引起的SEI外,通过涂层的人工SEI在保护锌阳极方面显示出一定的功能。对于一个好的人工涂层,有两个主要挑战:1.在温和的酸性水环境下保持结构;2.允许Zn2+渗透到涂层下沉积,而不是在涂层上生长,同时阻止H2O的还原。坚固的结构,如TiO2,ZnF2,Zn3PO4,已经显示出对循环稳定性和HER抑制的好处。其中,Wang等人比较了Zn2+在TiO2不同面的亲和力差异。通过设计低Zn2+亲和力(0 0 1)的面,进一步避免了锌在涂层上的成核,确保了TiO2 层下平滑均匀的锌沉积形态(图4b和c)。众多报道指出,磷酸锌是一种有前途的涂层材料。与TiO2相比,Zn3PO4更容易在Zn表面构建,通过酸蚀或电解质添加剂,可以在锌表面进行电化学分解并形成磷酸盐。此外,Wang等人表明,磷酸锌与Zn的(0 0 2)面具有良好的晶格匹配(图4d和e),这是一个众所周知的外延生长的面,没有枝晶物。因此,由H3PO4诱导的(0 0 2)取向锌的生长延长了循环寿命,形态更加平滑。尽管证明了其有效性,但这种单相无机材料的刚性使人们对沉积/剥离过程中锌的体积发生巨大变化后结构的完整性打上了问号。一个传统的好的SEI被认为同时具有有机部分和无机部分,其中有机材料缓冲体积变化以保持完整的涂层,无机盐提供离子传导性。人工SEI很少覆盖这两部分,可能会导致形成的SEI的稳定性较差。
另一个偷偷摸摸的角色是电解液中溶解的CO2,它经常促进SEI的形成(图4f)。与LIB系统类似,用CO2清洗电解液会带来更好的循环稳定性,形成富含Li2CO3的稳定SEI。 Zhong等人报告了AZIB中类似的行为,图4g显示了在使用CO2净化的电解液进行300次循环后的紧凑保护层,作为与空白电解液的粗糙锌形态的比较。受益于这样的涂层保护,即使在高放电深度(DOD)下,循环稳定性也大大改善,如图4所示。最近,研究表明,电极和电解质的分离层不一定是固体。由于静电的存在,电化学惰性阳离子可以作为电解质添加剂被吸收到锌阳极表面,从而有效地屏蔽了阳极并抑制了锌枝晶的产生。
三、低温性能
渐进式的极端天气使人们关注在低温下生存的电池。低温带来的变化,如电解液粘度增加,导致速率性能变差,电解液冻结甚至可能对电池造成致命的影响。
对于水性电池,尽管Wu等人报告了含有某些盐类的冷冻电解质(冰)显示出有希望的离子导电性(1 mS/cm的Li2SO4),这可能被用作固体电解质(图5a),但这只是理论上的猜测。一个更被接受的策略是调整电解质浓度以调整电解质的冰点(Tf)。冻结可以被看作是一个结晶过程,其中H2O分子以一种有序的方式重新组合起来。更具体地说,通过与相邻的水建立2个氢键,每个H2O分子形成四角形的几何结构。通过添加电解质盐,分子间的氢键被破坏,H2O的O2– 与Zn2+而不是与其他水分子的H+相互作用。减少的氢键网络为H2O的结晶创造了能量障碍,从而降低了Tf(图5b)。通过进一步增加浓度,阳离子-阴离子对形成,这削弱了O2–-Zn2+的相互作用,再次提高了Tf。按照这一思路,Chen等人通过溶解7.5 m ZnCl2 ,设法将水电解质的液体状态保持到-90℃。其他电解质盐如Zn(BF4)2,Zn(CF3SO3) 2 和3 M Zn(ClO4) 2在降低一定浓度的电解质的Tf方面也很有效。阳离子和阴离子在破坏H2O分子间氢键(HB)方面都起着重要作用。Wang et al.比较了各种阴离子的HB破坏能力,发现ClO > Br- >Cl- >SO42-之间的降低能力,这与Tf 的ClO4- >Br- >Cl->的降低能力很一致。so4拥有与H2O类似的结构,OH-与H2O竞争形成HB,KOH是一种众所周知的防冻电解质。
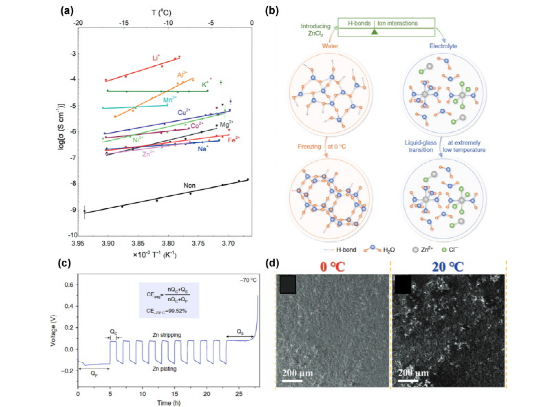
图5、(a)冰中不同离子的阿伦纽斯离子电导率图,由相应的硫酸盐溶液冷冻而成。(b) 水和电解质的结构演变示意图,以及低Tf 溶液的设计。(c) 70 °C下不对称锌-铜电池中锌镀层/剥离的电压曲线。 (d) Zn金属阳极在0 °C(左)和20 °C(右)循环的SEM图像。
有趣的是,由于抑制了HER反应,锌的沉积/剥离往往在低温下显示出更高的可逆性,同时沉积的锌的形态也更光滑。7.5 m ZnCl2 中的库仑效率从25 °C的97.93%提高到-70 °C的99.52%(图5c)。在3 M Zn(CF3SO3)2中做了更多的形态学差异研究,在0 °C下循环的Zn保持了光滑和紧凑的表面,没有枝晶的薄片。与此形成鲜明对比的是,在20℃下循环的Zn表面变得粗糙和松散(图5 d)。
尽管是反直觉的,但这种改进可以归因于被抑制的HER,其快速动力学长期以来一直是阳极操作的头痛问题,在水电池研究中被称为 "阴极挑战"。随着温度的降低,水的粘度增加和反应性被抑制,通过减缓HER的动力学,缓解了 "阴极挑战"。尽管在较低的温度下,Zn2+的还原也放慢了,但由于H2在Zn表面的堆积,较少的H+与H2O的解离,以及较少的H+/H2O的质量转移来供应持续的HER,因此,更多的Zn2+ 抓住电子被还原成Zn,而不是H+变成H2。
在阴极一侧也观察到类似的副反应抑制效应。OER反应,2H2O - 4e- =O2 + 4H+是一个4e-反应,与HER(2e-反应)相比,动力学上更加迟缓。降低温度(增加粘度)会对阴极侧的反应有更强的抑制作用,而且阴极反应的可逆性更好。然而,与不需要Zn2+扩散的阳极沉积不同,阴极材料需要在低温下在材料中进行良好的Zn2+扩散,只有少数结构符合标准。另一个避免阴极材料上缓慢的Zn2+扩散的策略是在阴极一侧采用次级电荷载体,如H+或Li+(更好的扩散)。
四、贫电解质
贫电解质是水电解质研究中的一个小众话题,人们往往忽略了它。然而,有限的电解质是水电池提高低能量密度的一个不可或缺的前提条件。贫电解质的直接影响是电解质中Zn2+储量的减少,这导致了容量的快速衰减和电解质的干燥。与锂离子电池中的贫电解质研究一样,电池失效的根本原因位于金属阳极上。由于库仑效率未能达到100%,在随后的剥离过程中,并非所有沉积的锌都具有电化学活性,损失的锌以死锌的形式存在(通常是枝晶)。这种损失需要在下一次沉积过程中由电解液中的Zn2+,从而 "消耗 "电解液来补充。由于贫瘠的电解液中的Zn2+,电解液往往会迅速干涸,电池的循环寿命也会缩短。在Swageloks电池内进行的大多数水电池研究,其电解液/容量(E/C)高达1000克/小时,是锂离子电池中传统 "精益电解液 "定义(3克/小时)的300倍左右。为了在电解液过剩的情况下保持类似的电化学性能,精益电解液系统必须要求阳极的库仑效率更高,阴极的可逆性更高,这样才能将电解液的消耗降到比较低 。
更重要的是,锰/钒基ZIB阴极材料在用作阴极时部分取决于溶解/沉积机制,其中低价态的Mn(+2)和V(+2,+3)是众所周知的可溶于水,而Mn(+3,+4,+5)和V(+4,+5)通常形成固体氧化物。正如之前的WISEs研究所证明的那样,电解液中较少的自由水使电极材料具有更高的稳定性,抑制了溶解,但由于高浓度而导致润湿性降低。电解液体积的减少不仅可能抑制活性材料的溶解,而且在电化学(去)插层之前,溶解电极的水也会减少。它可能迫使阴极经历固体↔固体Zn2+(去)插层,而不是固体↔液体溶解/沉积机制(如Mn2+ + 2H2O = MnO2 + 4H+ +2e- ,2V3+ + 5H2O = V2O5 + 10H+ + 4e- )。不幸的是,电解质量对MnO2 或V2O5 的电化学性能/机理差异的影响没有得到充分的探索。
【展望】
在这个角度,我们从五个指标来评估AZIB电解质的作用,并揭示了在不同的电解质成分/浓度下,电化学性能会有很大的不同。
从功利的角度来看,并不存在适合所有电池用途的电解液配方的万 能药。更高浓度的电解液无疑会扩大ESW并促进SEI的稳定性,然而,它也会产生离子对,增加电解液的粘度,降低离子的导电性,并提高溶液的冰点。对于高速性能和快速充电来说,快速Zn2+,优先考虑其他指标,同时要求尽量减少离子对/H+共传导,因此,超高的浓度可能不适合高速性能。当涉及到低温功能时,过低或过高的电解质浓度都会导致水的早期结晶,不能保持电解质的液体状态,阻碍Zn2+ 的传导。对于精益电解质的研究,材料的溶解受到抑制,但Zn2+储量也受到限制。我们预计WISE的电化学性能会更好,原因有二:1.由于水包盐电解质,SEI的形成带来了更高的可逆性,而水的反应性较低。2.在有限的电解质中,更多的Zn2+,从长远来看,可以弥补电极操作的不可逆性。
总的来说,在电解质设计方面,人们必须知道目的,然后才能选择正确的工具。从这个角度来看,通过揭示各种浓度及其对电解质功能的影响,我们提供了对溶液结构-性能关系的理解,这可以帮助设计具有一定功能期望的新电解质。
DOI: 10.1016/j.mattod.2023.04.005